イノベーションの特徴
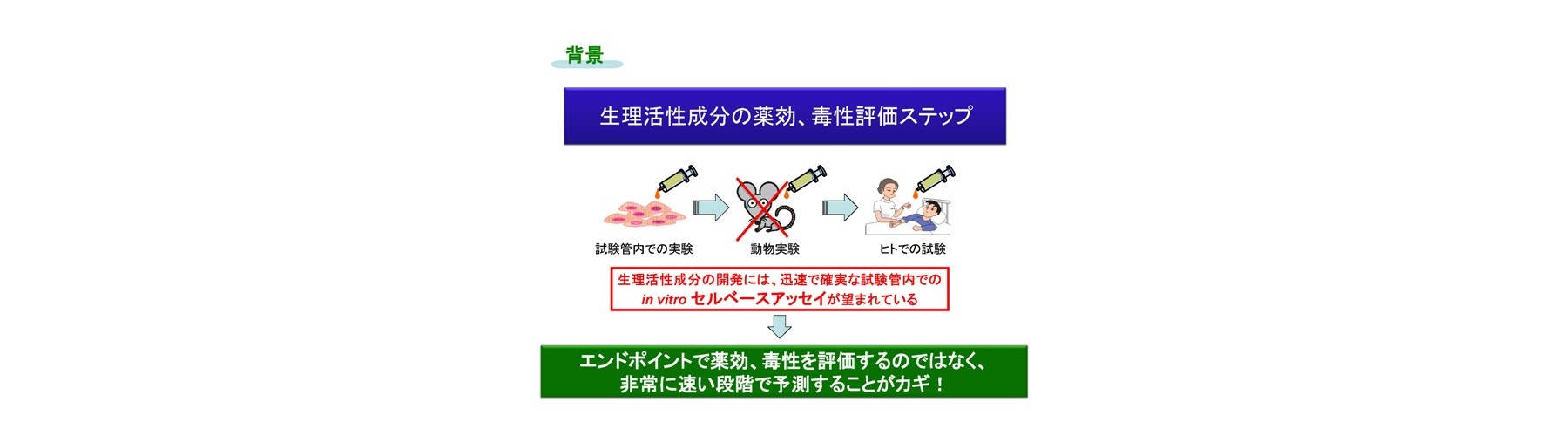
①イノベーションの背景
固形がん向けに以下のような研究を行ってきました。
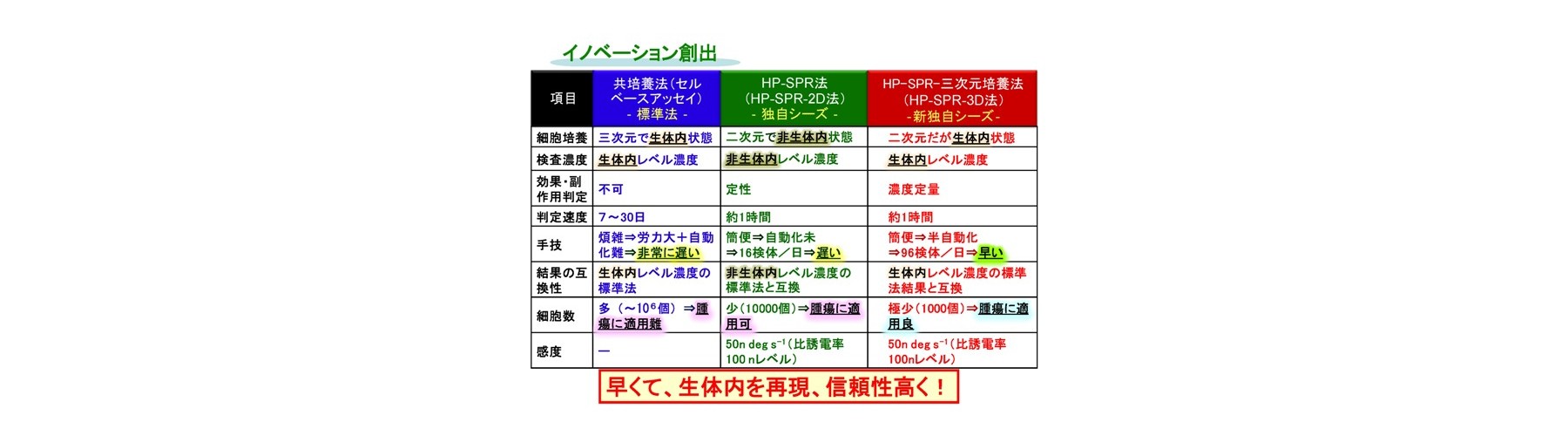
最適な抗がん薬剤の決定に用いられる感受性試験は、ヒトの細胞を用いて評価を行うセルベースアッセイが良く用いられます。セルベースアッセイでは、ヒトの細胞をシャーレの上で増殖し、抗がん剤を加え一定期間後、生存細胞をカウントするなどの方法が用いられます。従来型ではSuccinate dehydrogenase inhibition test(SDI)法など数多くありますが、全て培養を必要とするエンドポイント法であり長い培養期間が必要です。
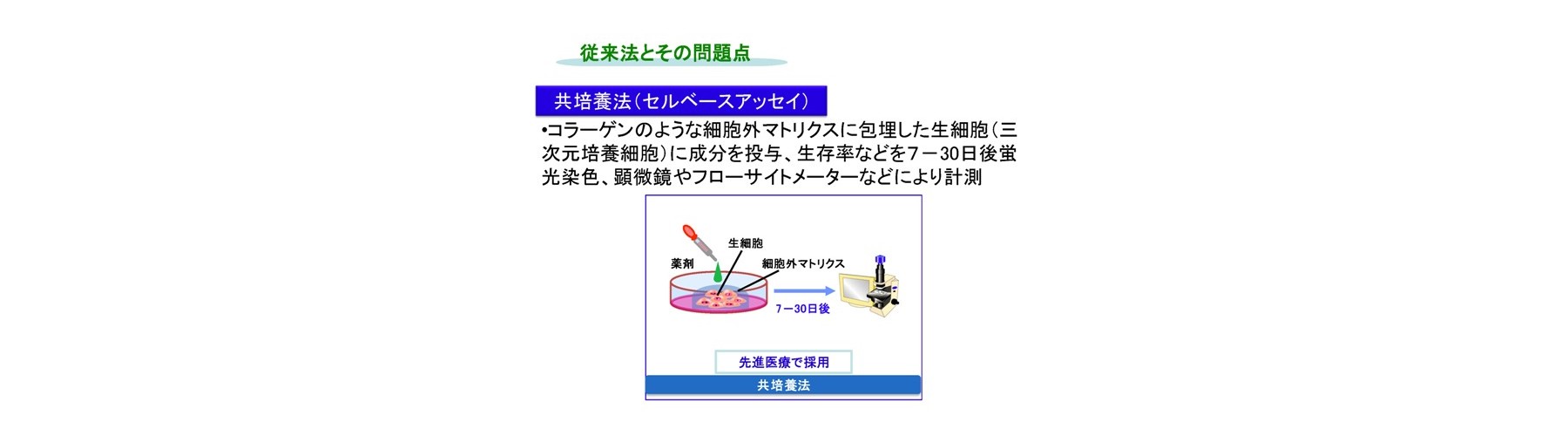
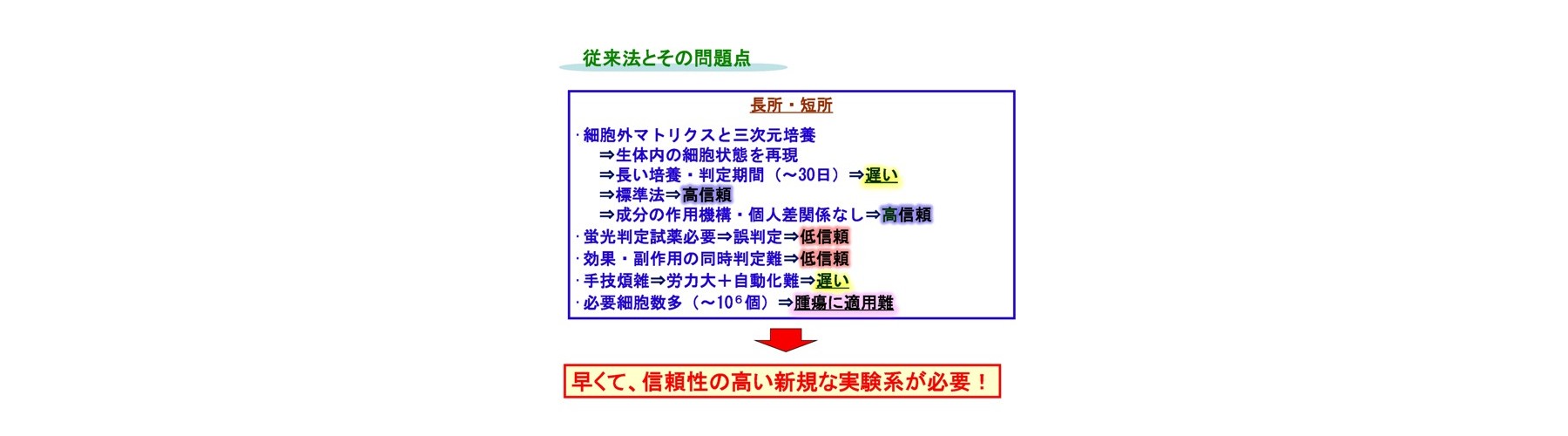
二次元培養法(非Growth assay)では長い判定期間(2日間)、蛍光色素と抗がん剤との競合反応による誤判定、判定試薬必要、多剤併用薬効の評価難です。二次元培養法はコストと簡便性から頻繁に用いられます。しかし、間質細胞など他の多くの細胞が取り除かれた特殊な環境であるため、現実にはあり得ない濃度で検討されていることが多い状況です。例えば、抗がん成分の濃度が生体内レベル濃度(生理的薬剤濃度)の10~100倍でないと効果が判定できません。このため、これらの試験では、効果がある、なしに特化され利用されるケースが多いです。当然、微小環境を維持している細胞や組織が望ましいですが、系の維持などの問題があります。このため、試験内実験であるIn vitro系において生体システムの再構成が行われます。生体内レベル濃度での測定のためには、コラーゲンのような細胞外マトリクスに包埋して培養するような三次元培養法(Growth assay)が用いられ、先進医療として認められています。しかしながら、三次元培養法では非常に長い判定期間(少なくとも7日間)、蛍光試薬使用による誤判定、判定試薬必要、手技煩雑、自動化難です。このため、迅速・確実に行えない問題があります。
Microphysiometerなどの新型薬剤感受試験では、測定対象が細胞外のpH、O2や薬剤の変化、細胞形態の変化などであり、半導体ベースのセンサーにより、インピーダンスなどの電磁気的な変化から測定します。細胞の三次元培養可、非標識、多項目の同時モニタリング、薬剤をフローさせ滞留させない、コラーゲン法を用いた場合に生体レベル濃度での評価可、薬剤耐性評価可などの長所を有し、毒性も評価可能です。しかし、測定項目が最終評価のキーではない、またその測定原理から想像されるように、電流などが細胞に対して悪影響し、本来の細胞のシグナルを計測ができないケースが多い状況です。このため、薬剤の作用機序に左右される、標準的方法による結果との相関低など、原理に由来する問題があります。更に、これらの手法・装置では、培養が必要なため長い判定期間(少なくとも標準的な方法に対して半分程度)が必要です(参考文献3、比較文献1-3)。オーミクスを用い薬剤治療効果との比較研究が多く行われていますが、多因子が関係、薬剤の作用機序に依存、多剤併用薬効の評価難であり、薬効の予測は発展途上です。
これらの問題のため、医療現場では、生細胞を用いたin vitro で迅速、簡便、非標識、高感度、かつ生体内レベル濃度で定量的に薬剤の作用機序に依らない迅速な評価方法、並びに評価装置が望まれています。
②イノベーションの特徴(図1参照)
上述の要求に対し、独自の手法を以下のように開発しています。
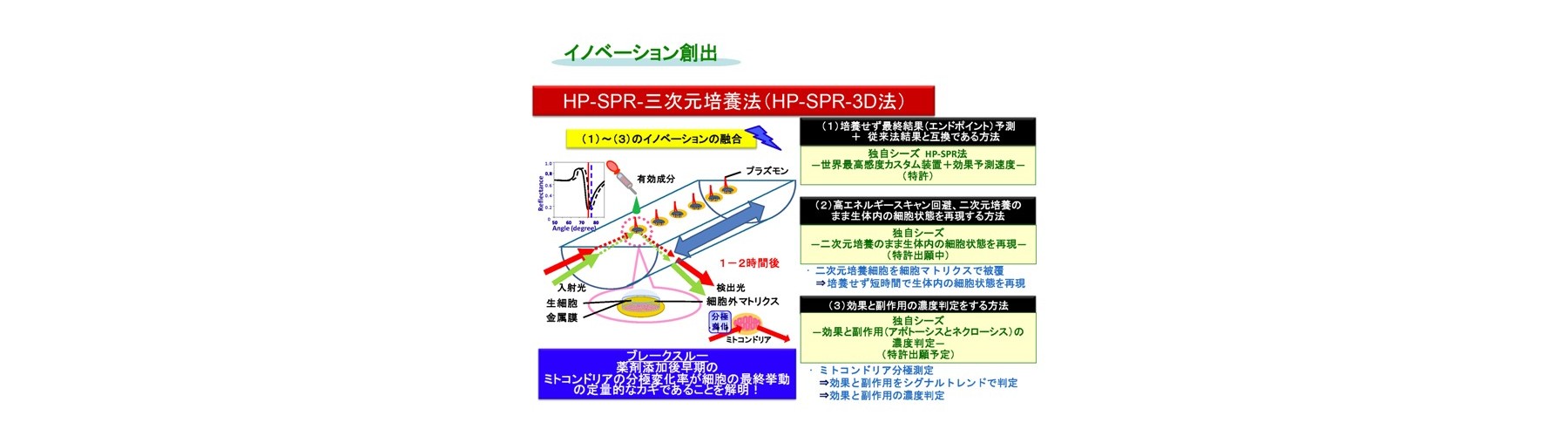
(1)培養せず最終結果(エンドポイント)予測 + 従来法結果と互換である方法
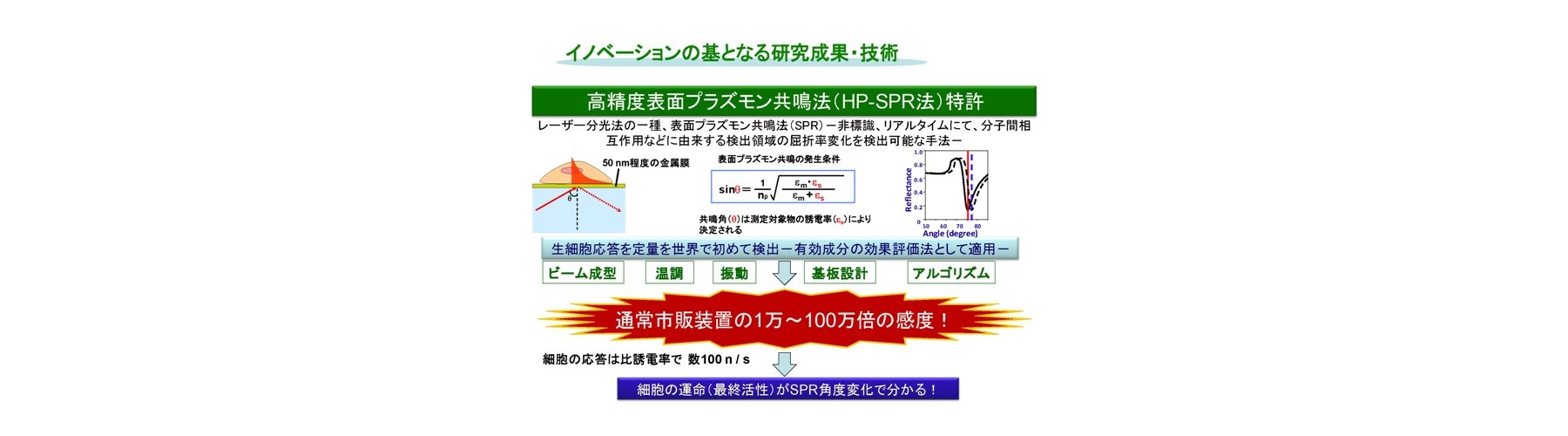
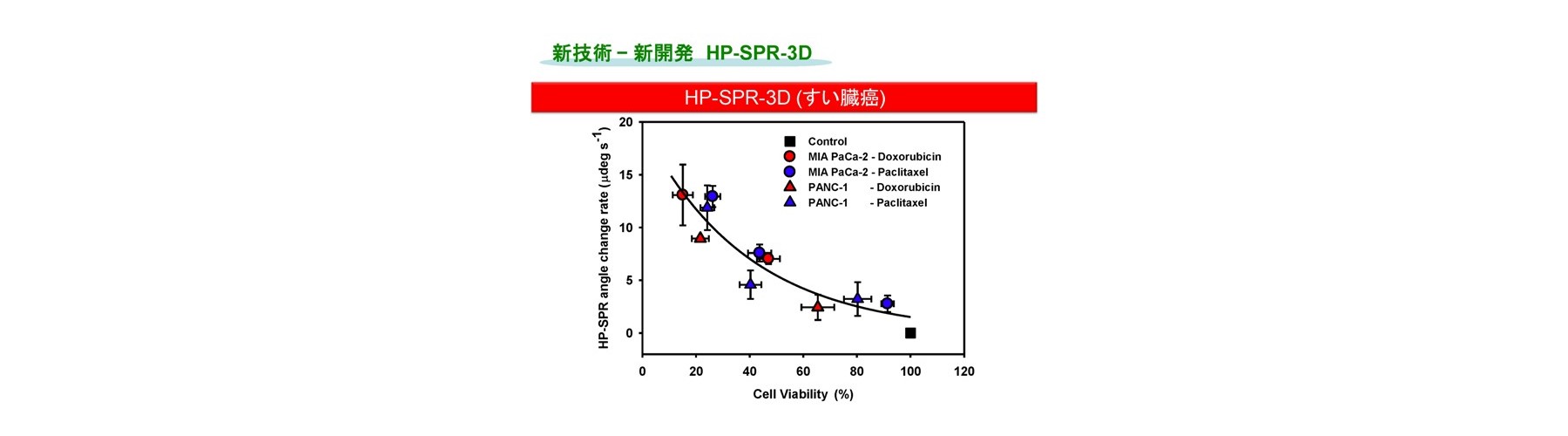
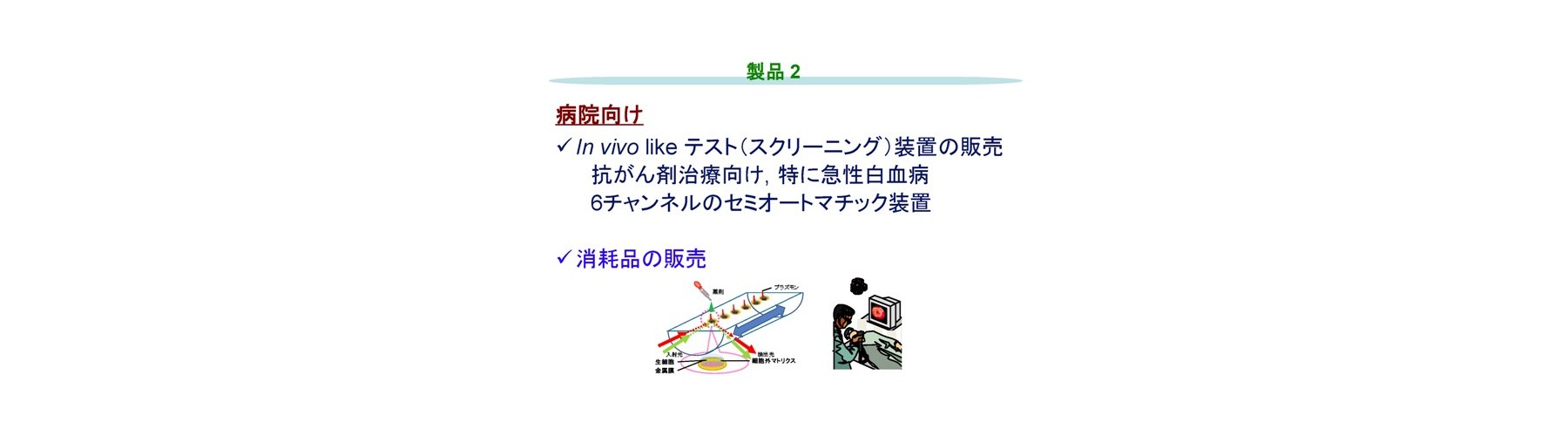
非標識、リアルタイムにて分子間相互作用などに由来する屈折率変化の検出法であり、レーザー分光法の一種である表面プラズモン共鳴法(SPR)を、抗がん成分(siRNA並びに機能性食品成分を含む)に対する生細胞の応答を光で定量的に検出し、薬剤効果の評価法として適用しました。まずSPRを高精度化した装置の開発(HP-SPR)により(50 ndeg s-1)感度不足を解消し、次にセンサーチップ上の約1,000 個の各種ヒト生固形がん細胞(膵がん、肝がん、乳がん、肺腺がん細胞株)をSPR基板に自己接着させて用い、HP-SPR上において薬剤(パクリタキセル、ドキソルビシン、などで多剤併用も含む)投与後1時間以内の応答リアルタイム検出(10分程度)を行いました。この結果、SPRシグナル変化率は48時間の二次元培養法における細胞生存率と、各種細胞株を用いても臓器ごとに有意義に高い相関があることが判明しました(図2)。遺伝子診断などの間接的、統計的な手法ではなく、薬剤の作用機序などに左右されず、多剤併用効果も含めた実データが高再現性、検出用試薬不要、短時間、自動化によりハイスループット化可能で得られ治療効果の個人差も含めて迅速・確実にスクリーニングする独自のシステムの開発に成功しました。正常(繊維芽)細胞を用い毒性評価も実現しました。HP-SPR により検出されるシグナルは、ミトコンドリア分極状態変化に由来します(図3)。これにより、エンドポイントを細胞の培養をせず迅速に予測するため、従来およびMicrophysiometerなどの新型感受性試験とは原理が異なります(出願特許1-3、参考文献1-3)。
生細胞に対し各種の抗がん剤を添加後の、細胞内ミトコンドリアのリアルタイムモニターから得られる分極状態の変化率が、定量的なキーであることを発見し、広く普及している非生体内レベル濃度を用いた標準的な方法による最終評価である抗がん作用ならびに副作用と互換であることを実証しています。これまでも、ミトコンドリアの定性的な関与が報告されていましたが、これが成分添加後の早期で定量的であることを実証しました。
本手法の特徴を以下にまとめます。
a)HP-SPR
高精度加工プリズム、レーザービームのコリメート、温調、除振台、角度検出アルゴリズムなどにより、50 ndeg s-1の超高精度です。細胞を金基板に自己接着させ、細胞内ミトコンドリア分極状態の選択的高感度検出(比誘電率で100 nレベル)を、測定細胞全体の平均値として定量的に行えます。細胞内のpH変化は検出しません。
b)薬剤測定前除去技術(図4)
薬剤と1時間接触し細胞内に導入した後、薬剤を培地に加えたままHP-SPR測定する場合、外乱により測定結果が乱れるケースがあり、この原因は薬剤が細胞膜に流入出するためと考え、1時間接触した後、薬剤を含まない培地に交換する薬剤測定前除去法を開発しています。これはSPRによる測定時間が短いため、既に流れたシグナルには影響しないことにもとづきます。本手法はミトコンドリア由来の分極の選択的検出に優れています。
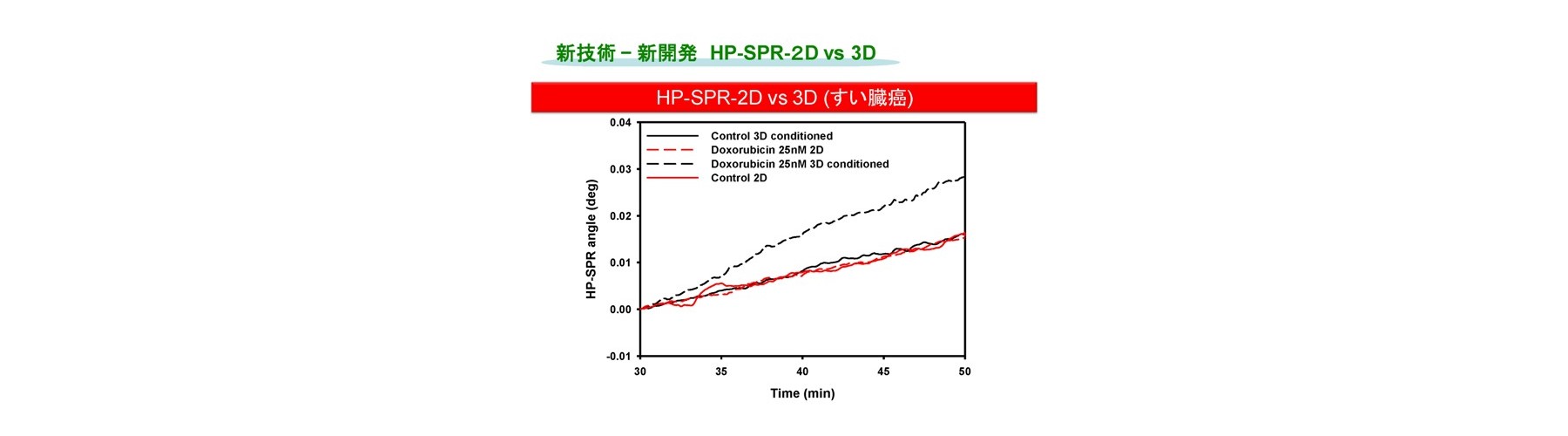
(2)高エネルギースキャン回避、二次元培養のまま生体内の細胞状態を再現する方法(図5)
HP-SPRを用い、センサーチップ上の二次元培養したヒトすい臓がん生細胞を細胞外マトリクスであるコラーゲンで覆い、安定化させ細胞本来の代謝に戻した上で薬剤を添加しHP-SPR測定することにより、二次元培養のまま臨床で使用される生体内レベル濃度でのスクリーニングへの手法の改良に成功しています(HP-SPR-3D)。得られるデータは、生体内レベル濃度での薬剤感受性試験 Collagen Droplet embedded culture Drug Sensitivity Test (CD-DST)法の結果と互換であり、テーラーメイド感受性スクリーニングとしてオンリーワン技術を確立しました(出願特許3)。生細胞の上面をコラーゲンで覆うと、細胞分裂を起こす前の短時間で細胞が活性化し、生体内と同様の反応をする三次元培養の状態になることを実証しました。
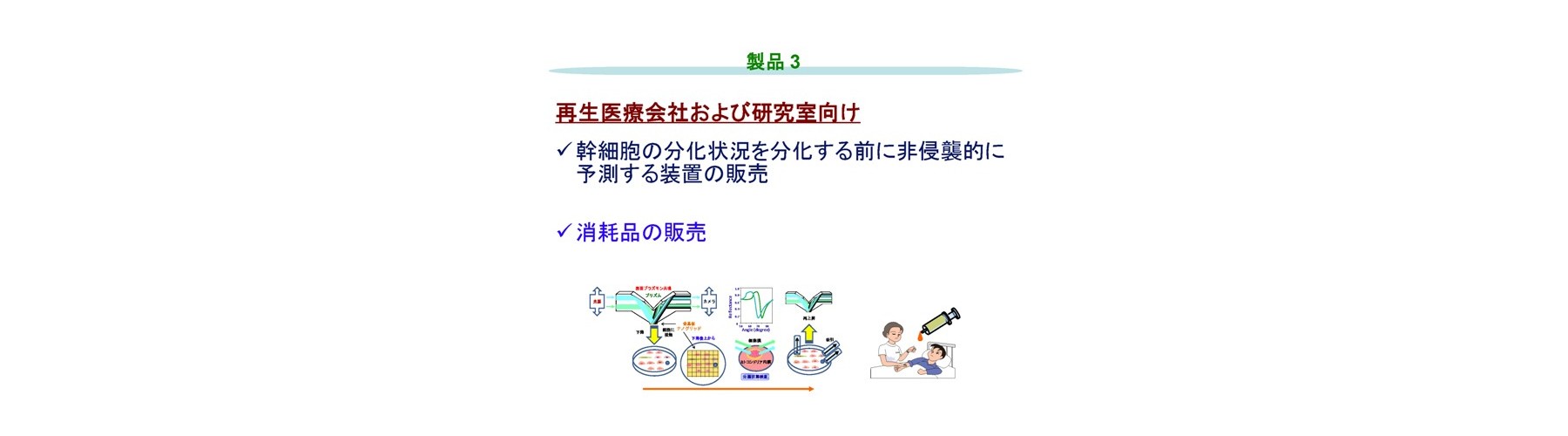
(3)非侵襲にて幹細胞の分化状態を分化開始前に予測
上述の原理により、幹細胞の次または最終の分化状態を分化開始前に予測可能にしています(出願特許2)。細胞内におけるミトコンドリアの分極状態の分布も含めたモニターにより、細胞の最終的な分化を予測することも可能です。細胞集団を一サンプルとして、一般に用いられる標識試薬を用いず、非標識で、低エネルギースキャンにより、細胞に毒性を生じさせずに、成熟機能性細胞を同定する手法です。これは、細胞をプレートから剥離することなく、対象となる全細胞を個別に検査するため、コンタミを防ぎ、純度を高く保つことが可能です。またがん化する細胞を含まず安全性が高く、さらに細胞活性の高いものが、ミトコンドリアの活性から評価・選別されます。
③競合品・類似品の有無
固形がんでは、Microphysiometerなどの新型薬剤感受試験装置があります。測定対象が細胞外のpH、O2や薬剤の変化、細胞形態の変化などであり、半導体ベースのセンサーにより、インピーダンスなどの電磁気的な変化から測定します。細胞の三次元培養可、非標識、多項目の同時モニタリング、薬剤をフローさせ滞留させない、コラーゲン法を用いた場合に生体レベル濃度での評価可、薬剤耐性評価可などの長所を有し、毒性も評価可能です。しかし、測定項目が最終評価のキーではない、またその測定原理から想像されるように、電流などが細胞に対して悪影響し、本来の細胞のシグナルを計測ができないケースが多い状況です。このため、薬剤の作用機序に左右される、標準的方法による結果との相関低など、原理に由来する問題があります。さらに、これらの手法・装置では、培養が必要なため長い判定期間(少なくとも標準的な方法に対して半分程度)が必要です。
このため、競合する製品・手法はありません。また、急性リンパ性白血病薬剤の迅速感受性試験のような浮遊がんに関して競合する装置・手法、並びに類似品は存在していません。
さらに、本システムでは細胞培養が不要なため、iPS細胞などの健全な長期細胞培養が困難な病態モデル幹細胞の利用による新薬開発に特に有効ですが、これもオンリーワン技術、並びに装置です。
一方、同原理により、幹細胞の次または最終の分化状態を分化開始前に予測可能にしています。これもオンリーワン技術、並びに装置で、競合品・類似品は存在していません。
出願特許
- Ona, T. and Kosaihira, A. Monitoring of intercellular mitochondrial polarization. WO2007/069692 A1 (2007); CN 200680052043.8 (2008); EP 1 961 824 A1 (2008); US 2011/0003321 A1 (2011); JP2012-93369A (2012).
- Nomura, M., Matsubara, E., Ona, T. Determination system, selection system, determination method, cell production method, program, and recording medium. JP2009-122016A (2009).
- Ona, T., Method for activating two-dimensional cultured cells similarly to three-dimensional culture or in vivo, and use thereof. WO 2013/039112 A1 (2013).
参考文献
- Kosaihira, A. and Ona, T. Rapid and quantitative method for evaluating the personal therapeutic potential of cancer drugs. Anal Bioanal Chem, 391:1889 (2008).
- Nishijima, H., Kosaihira, A., Shibata, J. and Ona, T. Development of signaling echo method for cell-based quantitative efficacy evaluation of anti-cancer drugs in apoptosis without drug presence using high-precision surface plasmon resonance sensing. Anal Sci, 26:529 (2010).
- Ona, T. and Shibata, J. Advanced dynamic monitoring of cellular status using label-free and non-invasive cell-based sensing technology for the prediction of anti-cancer drug efficacy. Anal Bioanal Chem, 398:2505 (2010).
比較文献
- Hatok, J., Babusikova, E., Matakova, T., Mistuna, D., Dobrota, D. and Racay, P. In vitro assays for the evaluation of drug resistance in tumor cells. Clin Exp Med, 9:1 (2009).
- Mestres, P. and Morguet, A. The Bionas technology for anticancer drug screening. Exp Opin Drug Discov, 4:785 (2009).
- Wlodkowic, D. and Cooper, J.M. Tumors on chips: oncology meets microfluidics. Cur Opin Chem Biol, 14:556 (2010).