1h in vivo-like スクリーニング装置
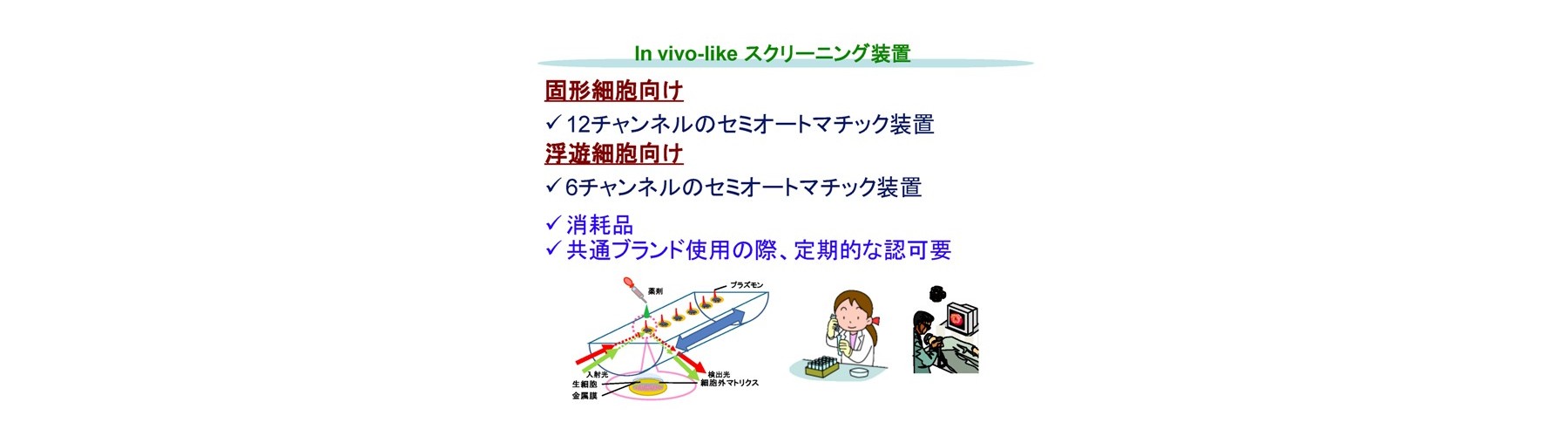
1.固形細胞向け装置 MitoPOM(Mitochondria polarization monitor)
生体内と同様のin vivo-likeスクリーニングを、固形生細胞を用い、抗がん剤のような薬剤(候補)や生理活性成分に対して行なうセルベースアッセイ装置です。一度に12サンプルの処理を行なうセミオートマチック装置です。従来法のin vivo-likeスクリーニングでは、高価なエンドポイントアッセイである細胞外マトリクスとの3D細胞培養であり、2-4週間の長い判定期間、蛍光色素と成分との競合反応による誤判定、判定試薬必要、効果と副作用(毒性)の同時判定が難しく、手技が煩雑で、労力が掛かります。一方、これまでの装置を用いる方法では、薬剤の作用機序に左右される、従来法の結果との相関低、多剤併用薬効の評価難という問題を抱えています。新技術では、レーザーにより薬剤に対する細胞の応答を動的にセンシングし、これらを全て克服しました。
技術的なブレークポイントは以下です。
- 新装置は、生細胞中のミトコンドリア分極状態を非標識、非侵襲的に高感度、低エネルギースキャンでリアルタイムモニターに成功
- 薬剤添加後の初期応答としてのミトコンドリア分極状態の変化率が、生細胞に対する最終的な(エンドポイントでの)薬効および毒性を予測する定量的な鍵であることを解明
- 2D細胞を細胞外マトリクスで短時間重層することにより、分裂させることなく、3D細胞活性の獲得に成功
製品の特徴は以下です。
- 手技簡便
- 培地交換不要
- 迅速な判定期間 (約1h)
- 判定試薬不要
- 誤判定なし
- 必要細胞数少 (1000個)
- 薬剤の作用機序に左右されない
- 多剤併用薬効の評価可
- 生理的濃度で評価可
- 標準法との相関高
- 薬効と毒性の同時判定可
確立しているアプリケーションは以下です。
- 抗がん
- 脂肪燃焼促進
- 代謝活性化
- アンチエイジング
- 肌のターンオーバー促進グ
- 冷え性改善
適用可能なアプリケーションは、ミトコンドリア関連のもので、例えば以下が挙げられます。
- 抗アルツハイマー
- 抗糖尿病
- 抗てんかん
- 育毛促進
- 美白促進
- 肌のしわ予防
これらは、ドラッグリポジショニング、並びに相乗効果やレスキュー効果のある成分の組み合わせの探求に最適です。これにより、古い、または捨てられた薬の再生が進み、知財化が可能になります。また、ドラッグデリバリーにおける効果の確認にも対応しています。
さらに、本システムでは細胞培養が不要なため、iPS細胞などの健全な長期細胞培養が困難な病態モデル幹細胞の利用による新薬開発に特に有効です。
受注生産品 価格 6,000~万円(税抜き)
2.浮遊細胞向け装置 DriaPOM(Mitochondria polarization monitor)
基本は固形細胞向け装置と同様ですが、一度に6サンプルの処理を行なう装置です。特に急性リンパ性白血病の治療では、基本となるのは抗がん剤を用いた化学療法であり、病型の判別をマーカーなどから1時間以内に行い、治療に入るのが通常です。最初の抗がん剤の選択が正しければ、小児の場合には80%以上が長期生存の可能性がありますが、思春期以降ではこれよりかなり悪い状況です。いずれにしても、この抗がん剤の選択判断は、非常に重要ですが、治療効果を有効に予測できていないのは、固形がんと同様です。このため、マーカー解析と同様に、1時間以内で、6種類の抗がん剤の薬効と毒性の判定を行い、初期寛解を促進することを特徴とします。
確立しているアプリケーションは抗がんで、適用可能なアプリケーションは、ミトコンドリア関連のもので、例えば免疫関連のNK細胞の活性化が挙げられます。
受注生産品 価格 6,000~万円(税抜き)
主な論文
Kosaihira, A. and Ona, T. Rapid and quantitative method for evaluating the personal therapeutic potential of cancer drugs. Anal Bioanal Chem, 391:1889 (2008).
Ona, T., Nishijima, H., Kosaihira, A. and Shibata, J. Development of cell-based quantitative evaluation method for cell cycle-arrest type cancer drugs for apoptosis by high precision surface plasmon resonance sensor. Biophotonics 9:69910R (2008).
Nishijima, H., Kosaihira, A., Shibata, J. and Ona, T. Development of signaling echo method for cell-based quantitative efficacy evaluation of anti-cancer drugs in apoptosis without drug presence using high-precision surface plasmon resonance sensing. Anal Sci, 26:529 (2010).
Ona, T. and Shibata, J. Advanced dynamic monitoring of cellular status using label-free and non-invasive cell-based sensing technology for the prediction of anti-cancer drug efficacy. Anal Bioanal Chem, 398:2505 (2010).
Ona, T. and Shibata, J. Label-free, rapid and reliable new chemosensitivity test for physiological concentration of anti-cancer drug: evaluation within 1h. J Pharm Sci, 121:132 (2013).
Ona, T. and Shibata, J. Label-free, rapid and reliable new cell-based assay for physiological concentration of anti-cancer and anti-metabolic syndrome compounds: evaluation within 1h. J Pharm Sci, 121:159 (2013).
Ona, T. and Shibata, J. Cell-based rapid and quantitative toxicity and efficacy monitoring in consecutive before and after the compound metabolism within liver for two ginger compounds at physiological concentration. ALTEX Proc, 3:24 (2014).
Ona, T. and Shibata, J. Rapid in vivo-like efficacy and toxicity evaluation of target compound using mitochondria activity change within epidermis keratinocyte cell. FRAGRANCE J, 42:50 (2014).
特許
Ona, T. and Kosaihira, A. Method of screening substance with anticancerous activity and apparatus therefor. JP2005-17081A (2005); WO 2005/001472 A1 (2005).
Ona, T. and Kosaihira, A. Monitoring of intercellular mitochondrial polarization. WO2007/069692 A1 (2007); CN 200680052043.8 (2008); EP 1 961 824 A1 (2008); US 2011/0003321 A1 (2011); JP2012-93369A (2012).
Ona, T., Method for activating two-dimensional cultured cells similarly to three-dimensional culture or in vivo, and use thereof. WO 2013/039112 A1 (2013).
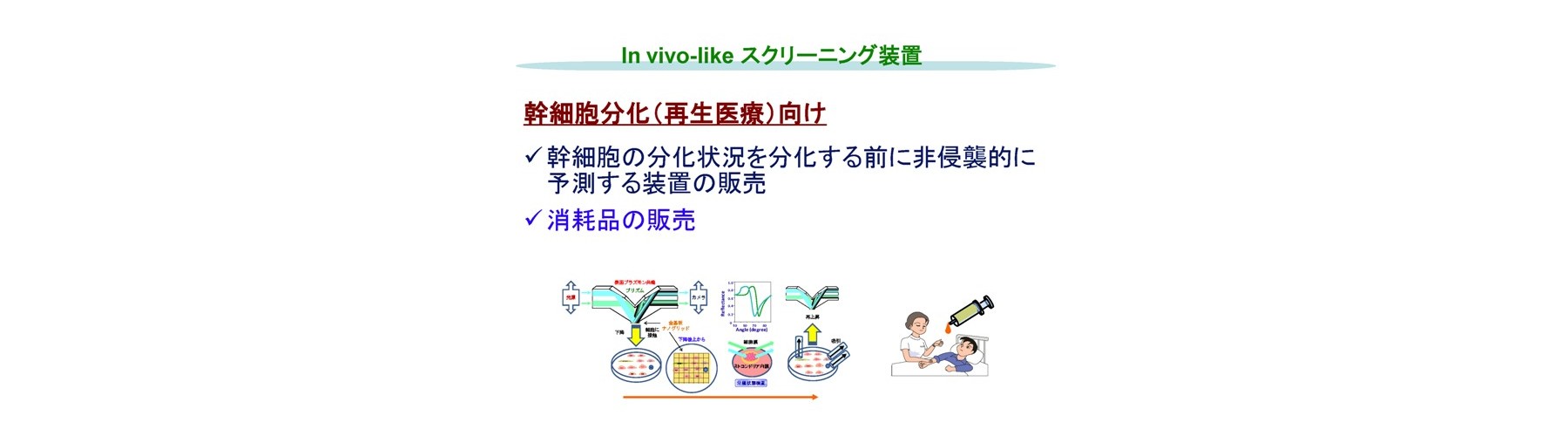
3.幹細胞分化向け装置 DiffPOM(Prediction of differentiation status of stem cell at the initiation by mitochondrial polarization monitoring)
本装置は、非侵襲にて幹細胞の分化状態を分化開始前に予測するものです。本手法も、基本は固形細胞向け装置と同様で、ミトコンドリア内膜の分極状態のモニターがベースになっています。これにより、幹細胞の次または最終の分化状態を分化開始前に予測可能にしています。細胞内におけるミトコンドリアの分極状態の分布も含めたモニターにより、細胞の最終的な分化を予測します。
臓器移植や人工臓器による重症臓器疾患治療を代替する方法として、iPS細胞などの幹細胞を利用した再生医療に期待が集まっています。これを実現するためには、純度が高く、安全で、治療効果が高い、成熟機能性細胞の生産は、重要な課題の一つです。
この目的のため、これまでの従来法では、細胞をプレートから剥離し、標識試薬を時に抗体と組み合わせて用い、細胞を染色しフローサイトメーターなどで高エネルギースキャンにより、全体の中の一部の細胞を検査することにより、目的の細胞を得る方法が用いられています。しかしながら、これらの方法は、標識試薬、高エネルギースキャンや細胞剥離により細胞毒性をもたらす、一部細胞検査のためコンタミをもたらす、また細胞活性は不明である、などの問題が指摘されています。
一方、独自技術として、細胞集団を一サンプルとして、一般に用いられる標識試薬を用いず、非標識で、低エネルギースキャンにより、細胞に毒性を生じさせずに、成熟機能性細胞を同定する手法の開発に、上述の独自のシーズを用いて成功しています。これは、細胞をプレートから剥離することなく、対象となる全細胞を個別に検査するため、コンタミを防ぎ、純度を高く保つことが可能です。またがん化する細胞を含まず安全性が高く、さらに細胞活性の高いものが、ミトコンドリアの活性から評価・選別されます。
本装置の使用により、効率的かつ安全な再生医療の実施が期待されます。また、幹細胞自体の品質管理や幹細胞からの臓器開発方法の効率化にも適用可能です。
受注開発・生産品 価格 12,000~万円(税抜き)
特許
Nomura, M., Matsubara, E., Ona, T. Determination system, selection system, determination method, cell production method, program, and recording medium. JP2009-122016A (2009).